商品名称:LuciAda
中文名称:阿达格拉西布
英文名称:Adagrasib
规格:200mg/片,90片/瓶。
【概括】
Adagrasib 是 KRAS G12C 的不可逆抑制剂,属于 RAS GTP 酶家族。分子式为C32H35ClFN7O2,分子量为604.1 g/mol。
化学名称为{(2 S)-4-[7-(8-氯萘-1-基)-2-{[(2 S)-1-甲基吡咯烷-2-基]-甲氧基}-5,6,7,8-四氢吡啶并 [3,4-d] 嘧啶-4-基]-1-(2-氟丙烯酰基)哌嗪-2-基}乙腈。
【适应症】
阿达格拉西布是RAS GTPase抑制剂,适用于治疗KRAS G12C突变的局部晚期或转移性非小细胞肺癌癌症(NSCLC)的成年患者,这些患者之前至少接受过一次全身治疗。
【贮存】
贮存于20°C ~25°C (68°C ~77°F);允许范围为15~30°C (59–86°F)温度条件下短途运输。
【用法用量】
1、患者选择
基于血浆或肿瘤标本中存在 KRASG12C 突变,选择接受 LuciAda 治疗的局部晚期或转移性 NSCLC 患者。如果在血浆标本中未检测到突变,则检测肿瘤组织。
关于 FDA 批准用于检测 KRASG12C 突变的检测方法的信息,可参见https://www.fda.gov/CompanionDiagnostics
2、推荐剂量
LuciAda 的推荐剂量为 600 mg 口服给药,每日两次,直至疾病进展或出现不可接受的毒性。
每天同一时间与或不与食物同服 LuciAda。整片吞服。请勿咀嚼、压碎或掰开片剂。
如果服用 LuciAda 后发生呕吐,请勿服用额外剂量。在下一个计划时间恢复给药。
如果因疏忽漏服一剂药物,如果已超过预期给药时间4小时,则应跳过该剂药物。在下一个计划时间恢复给药。
3、针对不良反应的剂量调整
不良反应的推荐剂量降低见表1。如果发生不良反应,最多允许减量2次。无法耐受 600 mg 每日一次的患者永久停用LuciAda。
表1:针对不良反应的 LuciAda 减量建议
剂量减少
|
剂量
|
首次剂量降低
|
400 mg 每日两次
|
第二次剂量降低
|
600 mg 每日一次
|
针对不良反应的推荐剂量调整见表2。
表2:针对不良反应的 LuciAda 剂量调整建议
不良反应
|
严重程度
|
剂量调整
|
尽管给予了适当的支持治疗(包括止吐治疗),仍发生恶心或呕吐
[参见警告和注意事项]
|
3级或4级
|
1、停用阿达格拉西布,直至恢复至≤1级或恢复至基线水平。
2、以下一个较低剂量水平恢复 阿达格拉西布治疗。
|
尽管给予了适当的支持治疗(包括抗腹泻治疗),仍发生腹泻
[参见警告和注意事项]
|
3级或4级
|
1、停用阿达格拉西布,直至恢复至≤1级或恢复至基线水平。
2、以下一个较低剂量水平恢复 阿达格拉西布治疗。
|
QTc 间期延长
[参见警告和注意事项]
|
QTc 绝对值大于 500 或者较基线延长超过 60 ms
|
1、停用阿达格拉西布,直至 QTc 间期小于481 ms 或恢复至基线。
2、以下一个较低剂量水平恢复 阿达格拉西布 治疗。
|
|
尖端扭转型室性心动过速、多形性室性心动过速或严重或危及生命的心律失常的体征或症状
|
永久停用阿达格拉西布。
|
肝脏毒性
[参见警告和注意事项]
|
2级 AST 或 ALT
|
将阿达格拉西布降低至下一个较低剂量水平。
|
|
3级或4级 AST 或 ALT
|
1、停用阿达格拉西布,直至恢复至≤1级或恢复至基线水平。
2、以下一个较低剂量水平恢复阿达格拉西布治疗。
|
|
AST 或ALT > 3×ULN且总胆红素 > 2×ULN,无其他原因
|
永久停用阿达格拉西布。
|
间质性肺病/非感染性肺炎
[参见警告和注意事项]
|
任何级别
|
1、如果怀疑 ILD/非感染性肺炎,停用阿达格拉西布。
2、如果发生以下情况,永久停用阿达格拉西布
确诊 ILD/非感染性肺炎。
|
其他不良反应
|
3级或4级
|
1、停用阿达格拉西布,直至
≤1级或恢复至基线水平。
2、以下一个较低剂量水平恢复 阿达格拉西布 治疗。
|
ALT = 丙氨酸氨基转移酶;AST = 天冬氨酸氨基转移酶;ULN = 正常值上限
*根据美国国家癌症研究所不良事件通用术语标准 (NCI CTCAE)5.0版定义的分级
【警告和注意事项】
1、胃肠道不良反应
LuciAda 可引起重度胃肠道不良反应。
在汇总安全性人群中 [见不良反应],观察到的严重胃肠道不良反应为胃肠道出血,发生率为3.8%,包括0.8%的3级或4级事件,1.6%的患者发生胃肠道梗阻,包括1.4%的3级或4级事件,0.5%的患者发生结肠炎,包括0.3%的3级事件,0.5%的患者发生肠梗阻,0.3%的患者发生狭窄。此外,366例患者中有89%发生恶心、腹泻或呕吐,其中9%为3级。29%的患者因恶心、腹泻或呕吐而中断给药或降低剂量,0.3%的患者永久停用adagrasib。
根据指征,监测和管理使用支持性治疗的患者,包括止泻药、止吐药或补液。根据严重程度暂停、减量或永久停用 LuciAda [见用法用量]。
2、QTc 间期延长
LuciAda 可导致 QTc 间期延长,从而增加室性快速性心律失常(例如,尖端扭转型室性心动过速)或猝死的风险。
在汇总安全性人群中 [见不良反应],366例至少进行了一次基线后心电图 (ECG) 评估的患者中,6%的患者平均QTc≥501 ms,11%的患者 QTc 较基线延长 > 60 ms。LuciAda可引起浓度依赖性 QTc 间期延长。
避免 LuciAda 与其他已知可能延长 QTc 间期的产品合并使用。[参见药物相互作用]。先天性长 QT 综合征患者和并发 QTc 延长的患者避免使用LuciAda。
在开始 LuciAda 治疗前、合并使用期间以及有临床指征的充血性心力衰竭、缓慢性心律失常、电解质异常患者和无法避免已知可延长 QT 间期的合并用药的患者中,监测 ECG 和电解质。根据严重程度暂停、减量或永久停用 LuciAda [见用法用量]。
3、肝脏毒性
LuciAda 可引起肝毒性,可能导致药物性肝损伤和肝炎。
在366例患者的汇总安全性人群中 [见不良反应],0.3%的患者报告了药物性肝损伤,其中0.3%为3级。共有32%接受 adagrasib 治疗的患者发生丙氨酸氨基转移酶 (ALT) 升高/天门冬氨酸氨基转移酶 (AST) 升高;5%为3级,0.5%为4级。至首次发生 ALT/AST 升高的中位时间为3周(范围:0.1-48周)。总体肝毒性发生率为37%,7%为3级或4级。12%的患者发生导致给药中断或剂量减少的肝毒性。0.5%的患者因肝毒性而停用Adagrasib。
在开始 LuciAda 治疗前监测肝脏实验室检查(AST、ALT、碱性磷酸酶和总胆红素),每月一次,持续3个月,或根据临床指征,在发生转氨酶升高的患者中更频繁地进行检查。根据严重程度减量、暂停或永久停用 LuciAda [参见用法用量和不良反应]。
4、间质性肺病/非感染性肺炎
LuciAda 可引起间质性肺病 (ILD)/非感染性肺炎,可能具有致死性。
在汇总安全性人群中 [参见不良反应],4.1%的患者发生 ILD/非感染性肺炎,1.4%为3级或4级,1例病例为致死性。至 ILD/非感染性肺炎首次发作的中位时间为12周(范围:5-31周)。0.8%的患者因 ILD/非感染性肺炎而停用Adagrasib。
在 LuciAda 治疗期间,监测患者是否出现提示 ILD/肺炎的新发或恶化的呼吸道症状(例如呼吸困难、咳嗽、发热)。疑似 ILD/非感染性肺炎患者停用LuciAda,如果未发现 ILD/非感染性肺炎的其他潜在原因,则永久停用 LuciAda [参见用法用量]。
【不良反应】
1、胃肠道不良反应 [见警告和注意事项]
2、QTc 间期延长 [见警告和注意事项]
3、肝毒性 [参见警告和注意事项]
4、间质性肺疾病 (ILD)/非感染性肺炎 [参见警告和注意事项]
具体不良反应见下表:
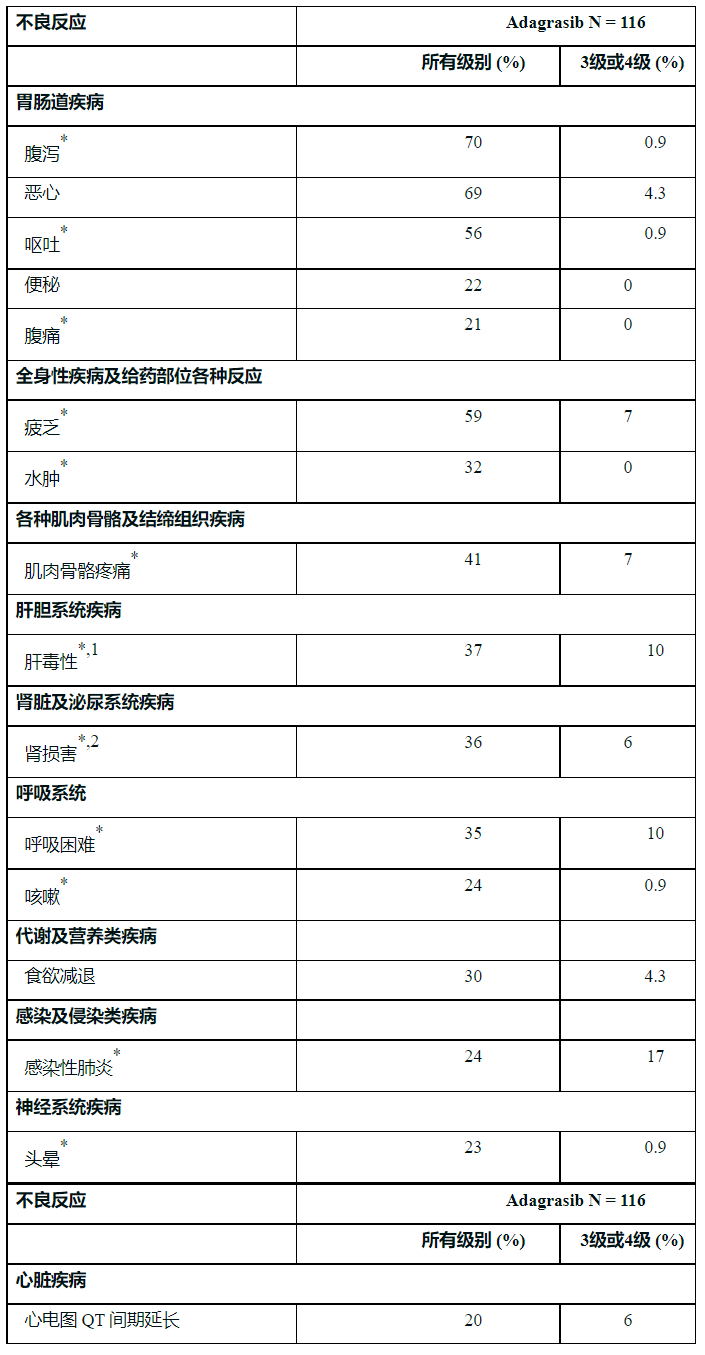
*成组术语。
1肝毒性包括混合性肝损伤、血碱性磷酸酶升高、丙氨酸氨基转移酶升高、天门冬氨酸氨基转移酶升高、肝功能检查升高、血胆红素升高和结合胆红素升高。
2肾损害包括急性肾损伤和血肌酐升高。
【药物相互作用】
1、其他药物对 LuciAda 的影响
a、强效 CYP3A4 诱导剂
避免 LuciAda 与强效 CYP3A 诱导剂合并使用。
Adagrasib 是一种 CYP3A4 底物。LuciAda与强效 CYP3A 诱导剂合并使用可降低 adagrasib 的暴露量 [见临床药理学 (12.3)],这可能会降低 LuciAda 的有效性。
b、强效 CYP3A4 抑制剂
避免 LuciAda 与强效 CYP3A 抑制剂合并使用,直至 adagrasib 浓度达到稳态(约8天后)。
Adagrasib 是一种 CYP3A4 底物。如果 adagrasib 浓度尚未达到稳态,则伴随使用强效 CYP3A 抑制剂将增加 adagrasib 浓度 [参见临床药理学 (12.3)],这可能增加 LuciAda 不良反应的风险。
2、LuciAda 对其他药物的影响
a、敏感 CYP3A 底物
除非这些底物的处方信息中另有建议,否则避免 LuciAda 与敏感 CYP3A 底物合并使用。
Adagrasib 是一种 CYP3A 抑制剂。与 LuciAda 合并使用增加了 CYP3A 底物的暴露量,这可能增加与这些底物相关的不良反应的风险。
b、CYP2C9 敏感底物
避免 LuciAda 与 CYP2C9 敏感底物合并使用,其中最小浓度变化可能导致严重不良反应,除非这些底物的处方信息中另有建议。
Adagrasib 是一种 CYP2C9 抑制剂。与 LuciAda 合并使用增加了 CYP2C9 底物的暴露,这可能增加与这些底物相关的不良反应的风险。
c、CYP2D6 敏感底物
除非这些底物的处方信息中另有建议,否则避免 LuciAda 与 CYP2D6 敏感底物合并使用,其中浓度微小变化可能导致严重不良反应。
Adagrasib 是一种 CYP2D6 抑制剂。与 LuciAda 合并使用增加了 CYP2D6 底物的暴露,这可能增加与这些底物相关的不良反应的风险。
d、P-gp 底物
避免 LuciAda 与 P-gp 底物合并使用,其中最小浓度变化可能导致严重不良反应,除非这些底物的处方信息中另有建议。
Adagrasib 是一种 P-gp 抑制剂。与 LuciAda 合并使用增加了 P-gp 底物的暴露量,这可能增加与这些底物相关的不良反应的风险。
3、延长 QTc 间期的药物
避免 LuciAda 与已知可能延长 QTc 间期的其他产品合并使用。如果无法避免伴随用药,则在开始 LuciAda 治疗前、伴随用药期间和有临床指征时监测心电图和电解质 [参见警告和注意事项]。如果 QTc 间期 > 500 ms或较基线变化 > 60 ms,则停用 LuciAda [见用法用量]。
Adagrasib 可导致 QTc 间期延长。LuciAda与延长 QTc 间期的其他产品合并使用可能导致 QTc 间期大幅延长以及与 QTc 间期延长相关的不良反应,包括尖端扭转型室性心动过速、其他严重心律失常和猝死 [参见警告和注意事项]。
【特殊人群用药】
1、妊娠
风险总结
尚无妊娠女性使用 LuciAda 的可用数据。在动物生殖研究中,在器官形成期间对妊娠大鼠和兔经口给予低于人体暴露量(推荐剂量为 600 mg 每日两次)的 adagrasib 时,未引起不良发育影响或胚胎-胎仔死亡(参见数据)。
在美国一般人群中,临床确认的妊娠中重大出生缺陷和流产的估计背景风险分别为2%-4%和15%-20%。
数据
动物数据
在大鼠胚胎-胎仔发育研究中,在器官形成期间每日一次对妊娠大鼠经口给予adagrasib,在 270 mg/kg 剂量水平(基于体表面积 [BSA],约为推荐剂量 600 mg 每日两次的2倍)下导致母体毒性(体重和摄食量减少,以及导致濒死状态和提前处死的不良临床体征)和胎仔体重降低。Adagrasib诱导骨骼。
270 mg/kg 剂量下观察到的畸形(如四肢弯曲)和骨骼变异(如肩胛骨弯曲、波状肋骨和多余的短颈肋骨)继发于母体毒性和胎仔体重降低。
在兔胚胎-胎仔发育研究中,器官形成期间每日一次经口给予adagrasib,在30 mg/kg(基于临床剂量 600 mg 每日两次的曲线下面积 [AUC],约为人体暴露量的0.11倍)下导致胎仔体重降低和未骨化胸骨的窝频率增加。这种骨骼变异与母体毒性相关,包括平均体重降低和摄食量减少。在剂量高达 30 mg/kg 每日一次时,Adagrasib暴露未引起不良发育影响,也未影响家兔的胚胎-胎仔存活率。
2、哺乳期
风险总结
尚无关于人乳汁中存在 adagrasib 或其代谢物、对母乳喂养婴儿或乳汁生成影响的数据。由于母乳喂养儿童可能发生严重不良反应,建议女性在 LuciAda 治疗期间和末次给药后1周内不要哺乳。
3、有生育能力的女性和男性
不孕症
基于动物研究的结果,LuciAda可能损害有生育能力的女性和男性的生育力。
4、儿童用药
尚未确定 LuciAda 在儿科患者中的安全性和有效性。
5、老年患者用药
在 KRYSTAL-1 中接受 adagrasib 600 mg 口服给药每日两次的116例患者中,49%(57例患者)的年龄≥65岁。在老年和年轻患者之间未观察到安全性或有效性的总体差异。

药老挝国家品批准文号:02 L 1070/24
药企介绍
卢修斯制药(老挝)有限公司(简称卢修斯制药),是一家现代跨国高新生物制药企业。目前拥有1个全球研发中心,与3家业内顶尖的研发团队合作,擅长复杂化学制剂及生物制剂研发,实现了关键仿制药品技术突破,目前卢修斯制药已成为全球专利仿制药研发能力最强的企业之一,在业界拥有良好的声誉的和市场口碑。
2020年卢修斯制药正式开启亚太战略,斥巨资在老挝首都万象投建亚太1号智慧工厂,按照GMP生产标准,引进中国、美国、德国等世界尖端制药设备,成立国际化高端制剂车间,年仿制药生产能力超15亿片。产品现已涵盖抗肿瘤、心血管、血液,糖尿病、皮肤病、男性保健、抗衰老等200多种品类,远销欧洲、南美洲、非洲、中东、印度、越南、尼泊尔等50多个国家和地区。
卢修斯在老挝建设了目前老挝最高标准的药品生产车间,自从老挝卢修斯建厂投产后, 公司将协同东南亚国家联盟,加快国际化进程,加强全球医药研发智力合作,丰富产品、提升质量,努力成为全球领先制药企业。
卢修斯制药的生产环境完全符合老挝、欧盟、美国和中国等国家的GMP(Good Manufacturing Practice,良好生产规范)标准。这意味着卢修斯制药的生产过程严格遵守了全球公认的质量管理和质量控制标准。

老挝卢修斯制药GMP认证证书
老挝卢修斯制药通过其先进的设施、严格的质量控制和广泛的业务范围,已经成为了老挝制药行业的一个重要玩家。
有了生产设备和车间,那么生产的药品质量怎么样呢?
老挝卢修斯的生产的每款药品都经过严格的检测,可以肯定的是老挝卢修斯仿制的药物药效是达到标准的,是完全放心的产品,
卢修斯的产品都是经过严格实验和检测,确保了产品的可靠,放弃购买老挝卢修斯制药的产品,可能就真的失去了一款药效可靠且还能省钱的机会。因为服用过老挝卢修斯产品的患者发现,服用价格低廉的卢修斯药品和之前服用其他药厂较高较高的产品药效竟然是完全一致。

世界卫生组织对老挝卢修斯进行访问并进行肯定

老挝卢修斯参加迪拜国际医药会展
为保障消费者权益,卢修斯产品实行二重防伪技术。
第一重:防伪贴上的6位流水防伪码,具有唯一性、不重复性不得沾污、刮损。(流水码重复或者刮损即认定为假冒产品,请患者与销售方退换)
第二重:防伪涂层,刮开涂层扫描对应的防伪码,输入对应的6(全新的产品在未验证时,二代防伪涂层下的防伪位防伪验证数字。码不得完全暴露)
需要特别注意的是,卢修斯的防伪码使用寿命仅有一次,有时候因为网络延迟等原因,不小心多点了几次验证,导致出现以下提示:
卢修斯制药作为全球卫生健康守护者,尖端制药行业精进者,秉承“关爱生命、服务健康”这一理念,与各国共同致力于提高优质医疗知识资源的生产、共享和利用,努力增强和维持肿瘤、艾滋病和免疫系统等疾病的预防治疗和护理,尤其发挥公司全球抗癌制药关键技术优势和抗癌产品质优价廉的特点,防范和降低危害人类健康。





 匿名用户
匿名用户  匿名用户
匿名用户  匿名用户
匿名用户  匿名用户
匿名用户  匿名用户
匿名用户